該研究收集了2007年至2011年在Utrecht大學醫學中心的多名20歲以下的患者��
。2歲以上患者的初始劑量參考表1��
。對於2歲以下兒童��
,使用2至12歲兒童的推薦初始劑量作為指導��
。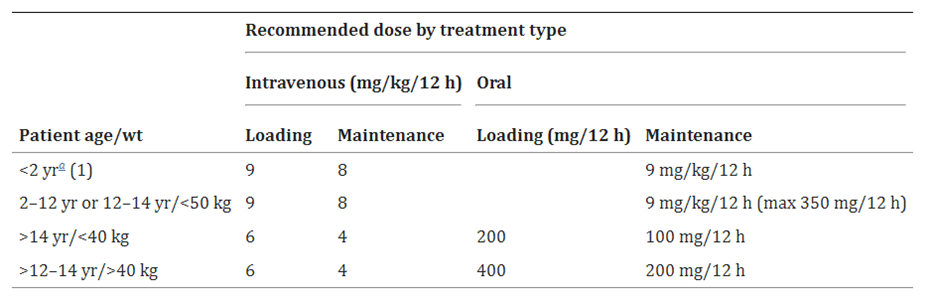
表格 1 目前伏立康唑的推薦劑量��,來源於產品特性總結(SPC)
伏立康唑使用者的人口學資料及其臨床特征匯總見表2��
。11例小於2歲患者��
,31例2 -12歲和20例大於12歲的患者��
。接受治療的27名兒童中有21名患有曲黴菌病(13名潛在��
,4名可能��
,4名確診)��
。41例小於2歲兒童患者(67%)的初始給藥劑量根據SPC或從SPC推斷��
。伏立康唑的處方中位期為64天(範圍6-415天)��
。最常見的停藥原因是免疫恢複(29例)或臨床改善(10例)��
。6例患者(10%)因毒性(肝毒性或蕁麻疹)停藥��
。由於毒性而停藥與患者年齡��
、給藥劑量或任何與伏立康唑TDM相關的參數無關(數據未顯示)��
。這6名患者在初始劑量時的中位Ctrough為0.5mg/L��
,在整個治療過程中測量的Ctrough最大值為3.3mg/L��
。

61例患者中共測量380次伏立康唑Ctroughs(平均每位患者8個樣本)��
。首次Ctrough測量是在4天(中位數)後進行的��
。接受推薦(或推測)劑量的患者(41例)的TDM結果見圖1和表3��
。34%的患者在初始劑量時達到足量水平��
:在小於2歲��
、2-12歲和12-20歲三個年齡組中比例分別為14%��
、32%和50% (P=0.354)��
。61%的患者存在Ctrough偏低的情況��
,其中56%的患者的伏立康唑Ctrough低於檢測限度(< 0.5mg/L)��
。另外有 5%的患者的初始Ctrough>5mg /L��
。通過靜脈注射給藥��
,38%的患者達到初始劑量��
,而口服給藥後為43% (P=0.800)��
。9例患者(20%)在整個治療過程中未達到治療濃度��
,即使進行了TDM調整, Ctrough仍然過低��
。1例患者在Ctrough在治療濃度範圍內前免疫恢複��
。在3例患者中��
,Ctrough在TDM的劑量調整下仍然變化很大��
。對於其餘的患者��
,沒有記錄為什麽劑量沒有升高到足夠的Ctrough��
。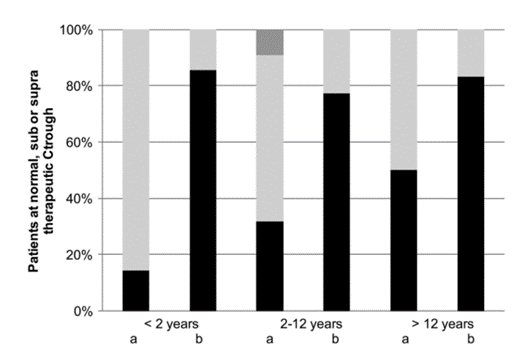
圖1伏立康唑治療藥物監測結果��
。所示為在初始推薦劑量或推測劑量(a)和基於TDM的(複發性)劑量調整(b)後��
,兒童達到正常��
、亞正常或超正常治療控製的百分比(分別為黑色��
、淺灰色和深灰色框)��
。結果按年齡組分(> 2歲��,2-12歲��
,以及>12歲)��
。
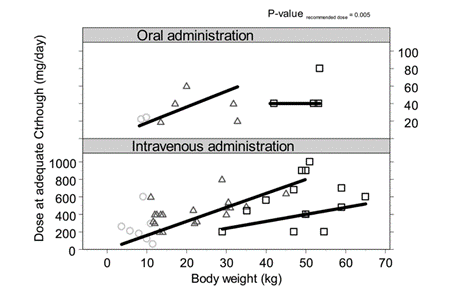
圖2每個年齡組日常滿足伏立康唑Ctrough劑量與體重相關的推薦(或推測)劑量��
。灰色圓圈表示2歲的患者��
,黑色三角形表示2 - 12歲患者的數據��
,黑色方塊表示12歲患者的數據��
。根據給藥途徑(口服或靜脈注射)將圖分開��
。黑色直線表示推薦劑量或推斷劑量��
。
在這些患者中使用伏立康唑的時間中位數是27天(範圍7-46天)��
。經TDM調整劑量後��
,80%的患者可以在10天的中位時間(範圍為3-41天)達到了足夠的Ctrough, 其中靜脈注射用藥患者占79%��
,口服用藥患者占85%��
。如圖2所示(P=0.005)��
,為了達到足夠的Ctrough劑量, 57%的患者劑量增加��,12%的患者劑量不變�
,30%的患者劑量下調��
,這與推薦劑量顯著不同��
。小於2歲兒童中��
,達到足夠Ctrough的中位日劑量為31.5mg/kg(範圍12-71mg/kg)�
。如圖3 (P=0.034)所示��
,對於2-12歲年齡組��
,達到足量水平的中位日劑量為16 mg/kg(13-55mg/kg)��
,12歲以上的則為9.4mg/kg(7.5-20mg/kg)��
。從這些數字可以看出患者間的變異性很高��
,且僅與年齡和/或體重部分相關��
。在治療過程中��
,濃度變化很大; 由於劑量變化和患者體內差異��
,每個患者體內達到的最低濃度和最高濃度可能相差10倍��
。在需要和不需要增加劑量的患者之間��
,沒有看到達到的其最高濃度的差異��
。在9名患者使用相同的日劑量治療期間�
,測得Ctrough的中位數存在2.9倍的差異��
。在治療過程中��
,5名患者的Ctroughs下降(中位數49%)�
,2名患者的Ctroughs增加(中位數170%)��
,2名患者的Ctroughs變化(在首個Ctrough的 56%-160%之間)��
。兩名7歲以下的患者波動最大��
,波動超過2 mg/L��
。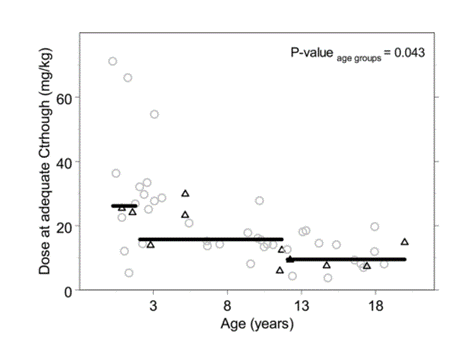
圖3每日伏立康唑劑量��
,毫克/公斤��
,在適當的Ctrough和年齡��
。黑色三角形為口服伏立康唑患者資料��
,灰色圓圈為靜脈注射伏立康唑患者資料��
。黑色直線顯示每個預定義年齡組的中位數
本研究對0.3-20歲的兒童和年輕人進行回顧性研究��
,以評估伏立康唑TDM在兒童HSCT中的價值��
。從年齡跨度��
、服藥方式��
、治療效果��
、TDM介入等看��
,該研究涵蓋了眾多臨床特殊情況��
,尤其是涵蓋眾多2歲以下的兒童病例�
。試驗數據表明��
,即便參照指導劑量進行治療��
,大多數兒童也沒有達到足夠的治療藥物水平��
,特別是在小於2歲兒童��
。此外��
,觀察同類型患者的CtroughS數值��
,也表現出個體間差異巨大��
,說明患者間對伏立康唑的PK存在很大的差異��
,也直接影響了伏立康唑的治療效果��
。在這種情況下��
,有必要引入TDM進行藥物劑量的調整��
。結果表明80%的患者在TDM的輔助下獲得了足夠的Ctrough��
。綜上所述��
,本研究表明��
,在兒科正確使用伏立康唑時��,治療性藥物監測是必不可少的��
,TDM有利於個體化用藥��
。兒童的劑量建議也需要進行修改��
,特別是對新生兒和學步兒童��
。參考文獻��
:
1. Schwartz, S., et al., Improved outcome in central nervous system aspergillosis, using voriconazole treatment. Blood, 2005. 106(8): p. 2641-5.
2. Schwartz, S., A. Reisman, and P.F. Troke, The efficacy of voriconazole in the treatment of 192 fungal central nervous system infections: a retrospective analysis. Infection, 2011. 39(3): p. 201-10.
3. Michael, C., et al., Voriconazole pharmacokinetics and safety in immunocompromised children compared to adult patients. Antimicrob Agents Chemother, 2010. 54(8): p. 3225-32.
4. Karlsson, M.O., I. Lutsar, and P.A. Milligan, Population pharmacokinetic analysis of voriconazole plasma concentration data from pediatric studies. Antimicrob Agents Chemother, 2009. 53(3): p. 935-44.
5. Pieper, S., et al., Monitoring of voriconazole plasma concentrations in immunocompromised paediatric patients. J Antimicrob Chemother, 2012. 67(11): p. 2717-24.